Las soluciones dispersas son sistemas en los que la fase está representada por partículas que varían en tamaño desde 1 nm hasta 10 micrones. Los sistemas dispersos son comunes, utilizados en la industria. Estos incluyen: aerosoles (gotitas o partículas sólidas suspendidas en el aire), emulsiones (gotitas líquidas disueltas en otro líquido por naturaleza), soluciones coloidales son sols (sistemas heterogéneos de dos fases cuyo tamaño de partícula es entre emulsiones y soluciones verdaderas, luego está dentro dede 1 a 100 nm . Las partículas dispersas pueden estar en un estado agregado diverso. El conjunto de partículas es una fase, y su combinación es un medio dispersado (líquido, gaseoso y sólido).
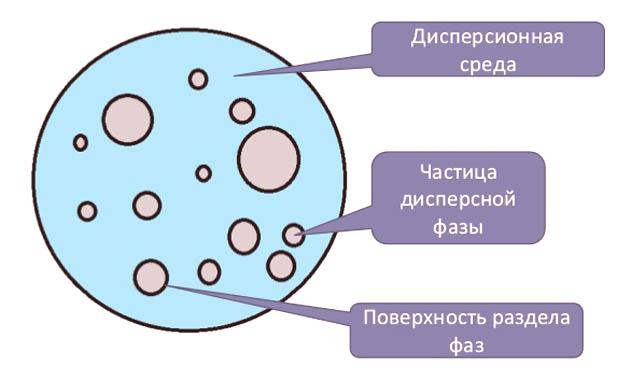
La composición del sistema disperso
Propiedades y uso de soluciones coloidales
En un sentido amplio, en esencia, los coloides sontodos los organismos naturales y plantas ambientales , la mayoría de los cuales tomamos con alimentos en estado coloidal. Los medicamentos, algunas pinturas e incluso materiales de construcción (materiales de unión de cemento y cemento, pinturas y cerámicas, materiales combustibles, fibras artificiales, plásticos) también se refieren a coloides.
Propiedades cinéticas de sistemas dispersos heterogéneos. El movimiento se debe a la diferencia en el tamaño de partícula. Una suspensión delgada capaz de movimiento aleatorio browniano. Por ejemplo, la grasa añadida al agua o la leche diluida con agua. El movimiento de partículas de una solución coloidal es termodinámico intensivo en energía.

OtroLa propiedad cinética de las soluciones esla difusión : el proceso de movimiento de partículas debido a las diferencias en sus concentraciones. Pero las partículas gruesas sólidas no participan en el movimiento caótico, pero la razón principal de su movimiento es la separación de la densidad de las fases en un medio disperso. Por lo tanto, si la densidad es mayor, entonces las partículas se asientan gradualmente bajo la acción de la gravedad, un proceso de sedimentación. Un proceso muy común utilizado en la química molecular de proteínas, moléculas de ácido nucleico e incluso bacterias. La presión osmótica de los coloides es muy pequeña, ya que el coloide tiene una gran masa.

Las propiedades ópticas de la solución se deben a la capacidad depara dispersar la luz , es decir, la presencia del fenómeno de opalescencia (debido a la heterogeneidad óptica). Se observa que si pasa un haz de luz a través de una cubeta, colocando una lente delante de usted, entonces desde el lado puede ver el efecto (cono de Tyndall). Esto se debe a la dependencia del tamaño de partícula de la solución y la longitud del haz de luz.
Se observa una dispersión si la longitud de onda es mayor que el tamaño de las partículas en la p-re. Si las partículas tienen el mismo tamaño que la longitud de onda, entonces el haz lo redondea y dispersa, es decir, se observa un fenómeno de difracción. Debido al espectro de dispersión, es posible determinar con precisión si la solución es verdadera (solución iónica, molecular o coloidal).
Soluciones verdaderas y sus propiedades
Las verdaderas soluciones son transparentes, soluciones homogéneas con una fase dispersa sólida, partículas de tamaño menor a un nanómetro, por lo tanto, el límiteDesaparece la separación de fases en solución. Las verdaderas soluciones se dividen en iónicas, si la fase dispersa consiste en iones hidratados (solución de cloruro de sodio o molecular (solución de glucosa). El agua es una parte indispensable de la vida, ya que todos los iones del cuerpo se disuelven en ella, gracias a ello se producen todos los procesos metabólicos entre células.

Diferencias entre coloides y soluciones verdaderas
Primero, las verdaderas soluciones son transparentes y homogéneas, las partículas en la fase dispersa son más pequeñas que un nanómetro. No se caracterizan pordifracción u opalescencia , no hay cono de Tyndall, es decir, las partículas son tan pequeñas que ni siquiera son visibles en un ultramicroscopio. Cuando se filtran, las soluciones coloidales no pasan a través de los filtros de papel, y los filtros verdaderos se filtran fácilmente, lo que muestra las diferencias entre el tamaño de partícula de la fase dispersa. Las verdaderas soluciones pasan a través de las membranas celulares. Termodinámico y no estable, estratificado, que es típico de las soluciones coloidales, y verdadero: no estratifica.
Las soluciones verdaderas pueden formarse espontáneamente, sin el costo de energía adicional, y la solución coloidal, por el contrario, es decir, el balance de energía para ellas no es estable. Las fuerzas de transformación entre fase y medio para soluciones verdaderas son bastante grandes, por lo que no necesitan un estabilizador. Las propiedades mecánicas de las soluciones son diferentes entre sí. Las soluciones verdaderas son más duraderas, ya que la fase dispersa es estacionaria, forma la estructura dentro de la cual se encierra el medio (por ejemplo, tejido óseo).La solución coloidal se dispersa libremente, tiene fluidez, por lo tanto, la concentración de la fase y el medio se distribuyen uniformemente (polvo, humo o niebla).