La valencia y el grado de oxidación son conceptos que se usan a menudo en química inorgánica. En muchos compuestos químicos, el valor de la valencia y el grado de oxidación del elemento coinciden, por esta misma razón, los escolares y los estudiantes a menudo se confunden. Estos conceptos realmente tienen algo en común, pero las diferencias son más significativas. Para entender la diferencia entre estos dos conceptos, vale la pena saber más sobre ellos.
Información sobre el grado de oxidación
El grado de oxidación es una cantidad auxiliar atribuida al átomo de un elemento químico o un grupo de átomos, que muestra cómo los pares de electrones comunes se distribuyen entre los elementos que interactúan.
Es un valor auxiliar que no tiene un sentido físico como tal. Su esencia se explica simplemente con la ayuda de ejemplos:
La molécula de sal comestibleNaClconsiste en dos átomos: un átomo de cloro y un átomo de sodio. El enlace entre estos átomos es iónico. El sodio tiene 1 electrón en el nivel de valencia, lo que significa que tiene un par de electrones común con un átomo de cloro. De estos dos elementos, el cloro es más electronegativo (tiene la propiedad de mezclar pares de electrones con él mismo), entonces el único par común de electrones se desplazará hacia él. En el compuesto, un elemento con una electronegatividad mayor tiene un estado de oxidación negativo, menos electronegativo, respectivamente, positivo, y su valor es igual al número de pares de electrones comunes. Para la molécula de NaCl considerada, los estados de oxidación del sodio y el cloro se verán así:
+1 -1
NaCl
Cloro, conel par de electrones desplazado hacia él ahora se considera como un anión, es decir, un átomo que se ha unido un electrón adicional a sí mismo, y el sodio como un catión, es decir, un átomo que dona un electrón. Pero cuando se registra el grado de oxidación, en primer lugar es un signo, y en el segundo, un valor numérico, y cuando se registra una carga iónica, y viceversa.
El grado de oxidación se puede definir como el número de electrones que un ion positivo carece de un átomo electroneutro, o que debe tomarse de un ion negativo para oxidar a un átomo. En este ejemplo, es obvio que el ion positivo de sodio debido al desplazamiento del par de electrones carece de un electrón, y el ion de cloro tiene un electrón adicional.
El grado de oxidación de una sustancia simple (pura), independientemente de sus propiedades físicas y químicas, es cero. La molécula O2 , por ejemplo, consta de dos átomos de oxígeno. Tienen los mismos valores de electronegatividad, por lo que los electrones comunes no cambian a ninguno de ellos. Esto significa que el par de electrones está estrictamente entre los átomos, porque el grado de oxidación será cero.
Para algunas moléculas, es difícil determinar dónde se mueven los electrones, especialmente si hay tres o más elementos en ellos. Para calcular el grado de oxidación en tales moléculas, necesitas usar algunas reglas simples:
- Un átomo de hidrógeno casi siempre tiene un estado de oxidación constante de +1 ..
- Para el oxígeno, este indicador es -2. Las únicas excepciones a esta regla son los óxidos de fluoruro
+2 -1 +1 -1
OF2y O2F 2 ,
Dado que el flúor es el elemento con mayor electronegatividad, por lo tanto, siempre desplaza los electrones que interactúan hacia sí mismo. De acuerdo con las reglas internacionales, el elemento con un valor eléctricamente negativo más bajo se registra primero, porque el oxígeno se encuentra en primer lugar en estos óxidos.
- Si sumamos todos los estados de oxidación en una molécula, obtendremos cero.
- Un estado de oxidación positivo es característico de los átomos metálicos.
Al calcular los estados de oxidación, uno debe recordar que el mayor estado de oxidación de un elemento es igual al número de su grupo, y el mínimo es el número de grupo menos 8. Para el cloro, el estado de oxidación máximo posible es +7, porque está en el séptimo grupo y el mínimo es 7 -8 = -1. 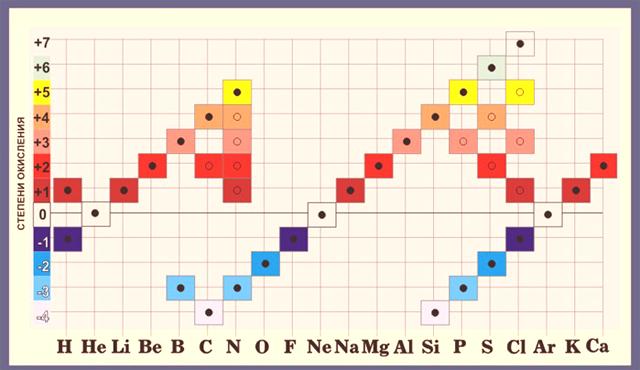
Información general de valencia
La valencia es el número de enlaces covalentes que un elemento puede formar en diferentes compuestos.
A diferencia del grado de oxidación, el concepto de valencia tiene un significado físico real.
La valencia más alta es igual al número del grupo en la tabla periódica. El azufre S se encuentra en el sexto grupo, es decir, su valencia máxima es 6. Pero también puede ser 2 (H2S) o 4 (SO2 ).
Casi todos los elementos se caracterizan por la valencia variable. Sin embargo, hay átomos para los cuales este valor es constante. Estos incluyen metales alcalinos, plata, hidrógeno (su valencia es siempre 1), zinc (valencia siempre es 2), lantano (valencia es 3). 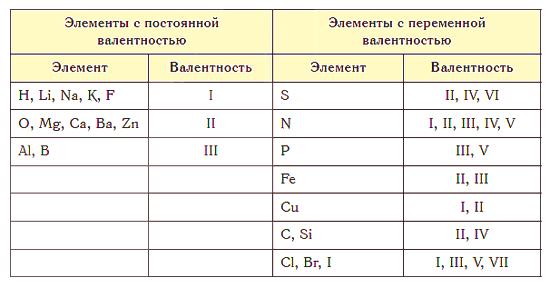
Lo que es común a la valencia y la oxidación
- Para referirse a ambos, yotros valores utilizan enteros positivos, que se escriben sobre la designación latina del elemento.
- La valencia más alta, como el mayor grado de oxidación, coincide con el número de grupo del elemento.
- El grado de oxidación de cualquier elemento en un compuesto complejo coincide con el valor numérico de uno de los indicadores de valencia. Por ejemplo, el cloro, que se encuentra en el séptimo grupo, puede tener una valencia de 1, 3, 4, 5, 6 o 7, lo que significa que los posibles grados de oxidación son ± 1, + 3, + 4, + 5, + 6, + 7.
Las principales diferencias entre estos conceptos
.- El concepto de "valencia" tiene un significado físico, y el grado de oxidación es un término auxiliar que no tiene un significado físico real.
- El grado de oxidación puede ser cero, mayor o menor que cero. La valencia es estrictamente mayor que cero.
- Valencia muestra el número de enlaces covalentes y el grado de oxidación: la distribución de los electrones en el compuesto.







