Los átomos y los iones son partículas microscópicas que consisten en un núcleo y electrones que orbitan a su alrededor. La principal diferencia, pero no la única, entre estas partículas es que el ion lleva una cierta carga, pero el átomo no.
Información general sobre átomos e iones
Un átomo es la partícula más pequeña de una sustancia que posee todas sus propiedades. El radio de un átomo se mide en picómetros (metros). Un átomo es eléctricamente neutro, es decir, una estructura sin carga que consta de un núcleo y electrones que giran a su alrededor. El núcleo de un átomo consiste en protones y neutrones, que también se llaman partículas subatómicas. Un protón transporta una carga positiva que es igual en magnitud a la carga de un electrón. Los neutrones no tienen carga. El número de electrones en un átomo corresponde al número de protones en el núcleo, lo que hace que el átomo en su conjunto sea eléctricamente neutral.
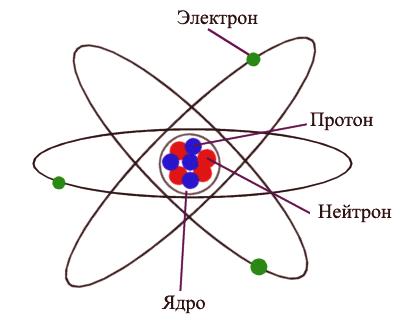
Átomo
Un ion es una partícula no elemental que lleva una carga positiva o negativa. Un ión se produce en el proceso de separar o unir un electrón a un átomo o un grupo de átomos. Un ion con una carga negativa (un átomo con un exceso de electrones) se llama anión, y un ion que lleva una carga positiva (átomo sin electrones) se llama un catión.
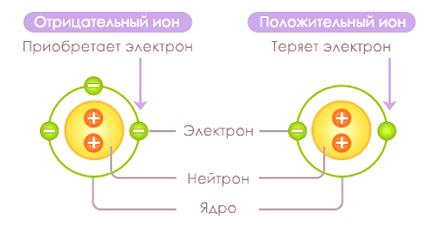
Iones
¿Cómo es la formación de iones
Un ion se forma a partir de un átomo en un proceso llamadoionización . Un catión se forma cuando un electrón en un átomo recibe energía de ionización, lo que le permite superar una barrera potencial y alejarse del átomo, superando las fuerzas de atracción electrostática. Proceso educativoEl anión ocurre con la liberación de energía cuando un átomo recibe un electrón adicional.
La ionización puede ocurrir debido a un aumento de la temperatura, la exposición a un campo eléctrico, rayos X o iluminación.
Ionización de gases
Algunos átomos no forman iones negativos. Por ejemplo, los gases inertes debidos a un nivel de electrones externos completamente completado no pueden unir otro electrón. Los gases inertes no reaccionan con otras sustancias en condiciones normales. La energía de ionización de los gases inertes es muy alta, en comparación con los átomos de otros elementos químicos, desde 10.8 eV para el radón hasta 24.6 eV para el helio. Un valor tan grande de la energía de ionización complica la formación de iones de gas inerte.
Todos los metales alcalinos (rubio, sodio, potasio, litio, cesio, Francia) son buenos agentes reductores, es decir, donan electrones a otros átomos fácilmente, convirtiéndose en iones cargados positivamente. Esto sucede debido a la baja energía de ionización - hasta 5 eV. Francius es el restaurador más poderoso. Los átomos de este elemento donan electrones más fácilmente que otros, debido a la muy baja energía de ionización. Los metales alcalinos tienen un solo electrón de valencia, y es más fácil regalar que unir siete electrones para completar el nivel de energía. Los metales alcalinos pueden convertirse en iones cargados positivamente simplemente por exposición a la luz.
El hidrógeno tiene una propiedad similar. Su átomo tiene un solo electrón y lo regala fácilmente, formando un catión.
Los halógenos: flúor, bromo, yodo, cloro y astato (los elementos que se encuentran en el subgrupo principal del 7º grupo de la Tabla periódica) tienen una alta electronegatividad: la propiedad de cambiar los pares de electrones comunes en el compuesto. Forman aniones fácilmente, ya que en el nivel externo ya tienen 7 electrones, y solo falta uno para completar el nivel. El bromo, el cloro, el yodo y la astatina pueden formar iones negativos y positivos al entrar en contacto con más elementos electronegativos. El flúor nunca forma iones positivos, ya que es el elemento con mayor electronegatividad y tiene una alta energía de ionización.
¿Qué es común entre el átomo y el ion?
Un átomo y un ión del mismo elemento tienen el mismo número de protones y neutrones en el núcleo.
Un ion se denota con el mismo símbolo que el elemento químico correspondiente en la tabla periódica, solo el valor de carga se indica a la derecha.
Diferencias entre el átomo y el ion
La principal diferencia entre un átomo y un ion es que el ion es una partícula cargada, y el átomo no es una cargada.
Además, un átomo y un ión del mismo elemento difieren en masa debido a la diferencia en el número de electrones. El catión tiene una masa más pequeña que el átomo del mismo elemento, y el anión, respectivamente, es más grande. La diferencia entre la masa de un átomo y la masa de un ion es un múltiplo de la masa del electrón.
Los iones, a diferencia de los átomos, no poseen las propiedades de una sustancia simple. Un ejemplo de esto son los cristales de yodo, que son de color azul oscuro en estado gaseoso.Púrpura, y sus iones son incoloros. Los iones de yodo no producen una reacción de color con el almidón y no son venenosos, a diferencia de los cristales.
Un ejemplo similar escobre . Este metal tiene un color rojo dorado, y sus iones son verde-azul.
El potasioes un metal plateado cuyos átomos reaccionan activamente con el agua, mientras que los iones de esta sustancia no poseen esta propiedad. La misma distinción es característica de las propiedades de los átomos y los iones de sodio.
El catión hidrógeno en la reacción con amoniaco forma el ion amonio. Para una molécula de hidrógeno, esta reacción no es típica.
Los átomos no se encuentran en la naturaleza por sí mismos, a diferencia de los iones. Las únicas excepciones son los gases inertes, que reaccionan con otros elementos solo en condiciones extremas. Si un ion se forma a partir de varios átomos, entonces es significativamente diferente de un átomo en tamaño y estructura. A diferencia de un átomo, un ion no pertenece a partículas elementales.
Los iones tienen un nivel completo de energía externa: tiene 8 electrones. Ningún otro átomo que no sea el gas inerte posee esta propiedad.