Muy a menudo es posible escuchar la opinión de que un átomo, como parte integral de una molécula, tiene las mismas propiedades y una estructura similar. Tal posición solo tiene parcialmente el derecho de existir, ya que las partículas tienen características comunes y distintivas. Para empezar, basta con considerar las propiedades de dos objetos, y sobre su base para sacar conclusiones adicionales.
Átomo
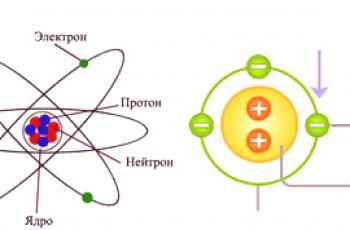
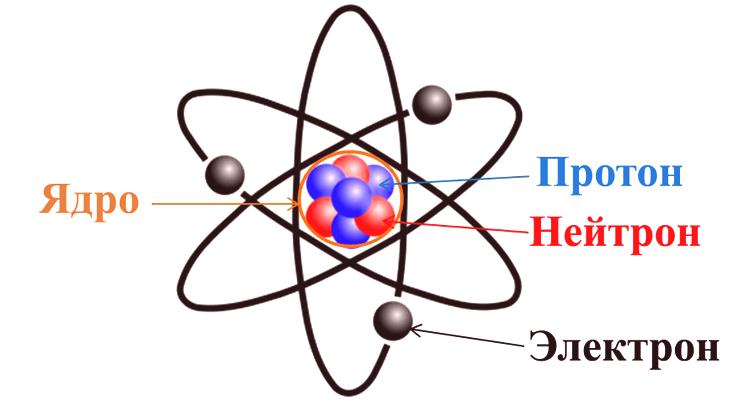
Un átomo puede considerarse comouna partícula elemental de una sustancia homogénea . Dicha sustancia, por definición, consta de un solo elemento químico (C, N, O y otros de la tabla periódica). Es la parte más pequeña de tales elementos que puede ser el portador de sus propiedades lo que se llama un átomo. Según los últimos conceptos modernos, un átomo consta de tres componentes: protones, neutrones y electrones.
Átomo
Las dos primeras subpartículas juntas constituyenel núcleo básico , que tiene una carga positiva. Los electrones que se mueven alrededor del núcleo introducen una carga de compensación con el signo opuesto. Por lo tanto, se llega a la primera conclusión de que la mayoría de los átomos son eléctricamente neutros. En cuanto al resto, debido a varios procesos fisicoquímicos, los átomos pueden unir o liberar electrones, lo que conduce a una carga. Un átomo tiene una masa y tamaño (determinado por el tamaño del núcleo) y determina las propiedades químicas de la sustancia.
Molécula
Una molécula esla unidad estructural mínima de una sustancia . Tal sustancia puede consistir en varios productos químicosartículos Sin embargo, una sustancia monoatómica de un elemento químico, un gas argón inerte, también puede considerarse una molécula. Como los átomos, es eléctricamente neutro. Es posible ionizar una molécula, pero es mucho más difícil: los átomos dentro de la molécula están conectados por enlaces covalentes o iónicos. Por lo tanto, se vuelve mucho más difícil adjuntar o recoger un electrón. La mayoría de las moléculas tienen una estructura arquitectónica compleja, donde cada átomo ocupa su lugar por adelantado.
La estructura de la molécula de agua
Átomo y Molécula: Propiedades Generales
Estructura . Ambas partículas son unidades estructurales de la materia. En este caso, un átomo significa un elemento particular, la molécula ya incluye varios átomos unidos químicamente, pero la estructura (núcleo positivo con electrones negativos) sigue siendo la misma.
Neutralidad eléctrica . En ausencia de factores externos (interacciones con otra sustancia química, un campo eléctrico dirigido y otros estímulos), los átomos y las moléculas no tienen carga.
Sustitución . Un átomo puede actuar como una molécula en un caso, cuando se trabaja con gases inertes. También el mercurio monatómico puede considerarse una molécula.
La presencia de masa . Ambas partículas tienen su propia masa clara. En el caso de un átomo, la masa depende del elemento químico y está determinada por el peso del núcleo (el protón es casi 1500 veces más pesado que el electrón, por lo que a menudo no se tiene en cuenta el peso de la partícula negativa). Masa de moleculaDeterminado en base a su fórmula química - los elementos que lo componen.
Átomo y molécula: excelentes propiedades
Indivisibilidad . El átomo es el elemento más pequeño del cual es imposible seleccionar una partícula aún más pequeña. (Obtener un ion afecta solo la carga, pero no el peso). La molécula, a su vez, se puede dividir en moléculas más pequeñas o se puede descomponer en átomos. El proceso de descomposición se logra fácilmente utilizando catalizadores químicos. A veces basta con calentar la sustancia.
Libre existencia . La molécula puede existir libremente en la naturaleza. Un átomo existe en forma libre solo en dos casos:
- Como mercurio monoatómico o gas inerte.
- En las condiciones del espacio, como átomos separados puede haber cualquier elemento químico.
En otros casos, el átomo es siempre parte de la molécula.
Formación de una carga . La interacción entre el núcleo y el electrón en el átomo se puede superar fácilmente incluso con el campo eléctrico más pequeño. Por lo tanto, es fácil obtener un ion positivo o negativo de un átomo. La presencia de enlaces químicos entre átomos dentro de la molécula requiere la aplicación de un campo eléctrico mucho más grande o la interacción con otra sustancia químicamente activa.