Antes de responder a la pregunta planteada en el título del artículo, veamos cuál es el par. Las imágenes que aparecen en la mayoría de las personas con esta palabra: un hervidor o cacerola hirviendo, un baño de vapor, una bebida caliente y muchas otras imágenes similares. De todos modos, en nuestras ideas hay un líquido y una sustancia gaseosa que se eleva sobre su superficie. Si se le pide que dé un ejemplo de vapor, inmediatamente recordará vapor de agua, vapor de alcohol, éter, gasolina, acetona.

Hay otra palabra para estados gaseosos -gas . Aquí generalmente recordamos oxígeno, hidrógeno, nitrógeno y otros gases, sin asociarlos con los líquidos apropiados. Es bien sabido que existen en estado líquido. A primera vista, las diferencias radican en el hecho de que el vapor corresponde a los líquidos naturales, y los gases deben licuarse específicamente. Sin embargo, esto no es del todo cierto. Además, las imágenes que surgen de la palabra vapor - vapor no lo son. Para dar una respuesta más precisa, veamos cómo surge el vapor.
¿En qué se diferencia el vapor del gas?
El estado agregado de una sustancia está determinado por la temperatura, más precisamente, la relación entre la energía con la que interactúan sus moléculas y la energía de su movimiento caótico térmico. Aproximadamente, podemos suponer que si la energía de interacción es mucho mayor, un estado sólido, si la energía del movimiento térmico es mucho mayor, gaseosa, si es comparable, la energía es líquida.
Molécula de gas
Resulta que la molécula podría separarse deLíquido y participar en la formación de vapor, la cantidad de energía térmica debe ser mayor que la energía de interacción. ¿Cómo puede pasar esto? La tasa promedio de movimiento térmico de las moléculas es igual a un cierto valor, dependiendo de la temperatura. Sin embargo, las velocidades individuales de las moléculas son diferentes: la mayoría de ellas tienen velocidades cercanas al valor promedio, pero algunas de ellas tienen velocidades más altas que el promedio, algunas menos.
Las moléculas más rápidas pueden tener energía térmica mayor que la energía de interacción y, por lo tanto, una vez en la superficie del líquido, pueden desprenderse de ella, formando vapor. Este método de vaporización se llamaevaporación . Debido a la misma distribución de velocidad, existe un proceso opuesto: condensación: las moléculas del vapor pasan al líquido. Por cierto, las imágenes que suelen aparecer cuando los pares de palabras no son vapor, sino el resultado del proceso opuesto: la condensación. El vapor no se puede ver.

Evaporación
Bajo ciertas condiciones, el vapor puede convertirse en líquido, pero para esto su temperatura no debe exceder cierto valor. Este valor se llama temperatura crítica. El vapor y el gas son estados gaseosos caracterizados por la temperatura a la que existen. Si la temperatura no excede el crítico - vapor, si excede - gas. Si la temperatura se mantiene constante y el volumen se reduce, el vapor se licua, el gas no se licua.
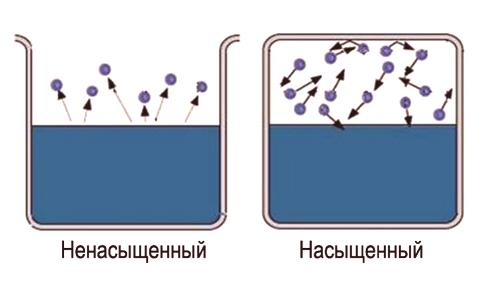
Qué es vapor saturado e insaturado
La palabra "saturado" en sí lleva ciertoLa información es difícil de saturar una gran área de espacio. Entonces, para obtener vapor saturado, es necesariolimitar el espacio en el que se encuentra el líquido . La temperatura debe ser menos crítica para esta sustancia. Ahora las moléculas evaporadas permanecen en el espacio donde se encuentra el líquido. Primero, la mayoría de las transiciones moleculares ocurrirán desde el líquido, mientras que la densidad del vapor aumentará. Esto a su vez causará un mayor número de transiciones inversas de moléculas en un líquido, lo que aumentará la velocidad del proceso de condensación.
Finalmente, se establece un estado para el cual el número promedio de moléculas que se mueven de una fase a otra será igual. Este estado se llamaequilibrio dinámico . Este estado se caracteriza por el mismo cambio en la magnitud y dirección de las tasas de evaporación y condensación. Este estado corresponde a un par saturado. Si no se alcanza el estado de equilibrio dinámico, esto corresponde a un par insaturado.
Comienza el estudio de un objeto, siempre con su modelo más simple. En una teoría cinética molecular, este es un gas ideal. Las principales simplificaciones aquí son el abandono del propio volumen de moléculas y la energía de su interacción. Resulta que tal modelo describe bastante satisfactoriamente el vapor insaturado. Y cuanto menos saturado es, más legítima es su aplicación. Un gas ideal es un gas, no puede convertirse en vapor o líquido. Por lo tanto, para vapor saturado, este modelo no esadecuado
Las principales diferencias entre vapor saturado e insaturado
- Saturado significa que el objeto tiene el mayor valor posible de algunos parámetros. Para vapor, esdensidad y presión . Estos parámetros para vapores insaturados tienen valores más pequeños. Cuanto más lejos esté el vapor de la saturación, más pequeños serán estos valores. Una aclaración: la temperatura de referencia debe ser constante.
- Para un vapor insaturado, se cumple laley de Boyle - Mariotte : si la temperatura y la masa del gas son constantes, un aumento o disminución en el volumen provoca una disminución o aumento de la presión en la misma cantidad, la presión y el volumen son inversamente proporcionales. A partir de la densidad y presión máximas a una temperatura constante, sigue su independencia del volumen de vapor saturado, y resulta que para el vapor saturado, la presión y el volumen no dependen entre sí.
- Para vapores insaturados , la densidad no depende de la temperatura , y si se conserva el volumen, el valor de la densidad tampoco cambia. Para vapor saturado, mientras se mantiene el volumen, la densidad cambia si cambia la temperatura. La dependencia en este caso es directa. Si la temperatura aumenta, la densidad aumenta, si la temperatura disminuye, la densidad también cambia.
- Si el volumen es constante, el vapor insaturado se comporta de acuerdo con la ley de Charles: a medida que aumenta la temperatura, la presión aumenta en la misma cantidad. Tal relación se llama lineal. A vapor saturado con aumento de la presión de temperatura.Se eleva más rápido que el vapor insaturado. La dependencia es exponencial.
Resumiendo, podemos notar diferencias significativas en las propiedades de los objetos comparados. La principal diferencia es que el vapor, en estado de saturación, no puede considerarse aislado de su líquido. Este es un sistema de dos componentes al que la mayoría de las leyes de gas no se pueden aplicar.