En química orgánica, hay dos clases principales de éteres: simples y complejos. Estos son compuestos químicos formados durante la hidrólisis (separación de una molécula de agua). Los éteres (también se denominan ésteres) se obtienen por hidrólisis de los alcoholes correspondientes, y los ésteres (ésteres) se obtienen mediante el alcohol y el ácido correspondientes.
A pesar del nombre similar, los éteres y los ésteres son dos clases de compuestos completamente diferentes. Se obtienen de diferentes maneras. Tienen diferentes propiedades químicas. Se diferencian en la fórmula estructural. En general, solo hay algunas de las propiedades físicas de los más famosos de sus representantes.
Propiedades físicas de los ésteres y ésteres
Los éteres son poco solubles en agua, líquidos de bajo punto de ebullición, fácilmente inflamables. A temperatura ambiente, los éteres son líquidos incoloros que huelen agradablemente. 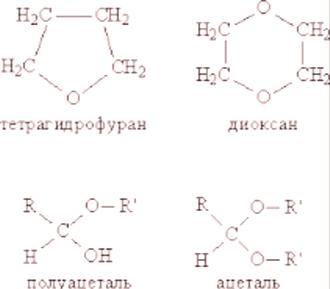
Ésteres de bajo peso molecular: evaporan fácilmente los líquidos incoloros, huelen bien, a menudo son frutas o flores. Con un aumento en la cadena de carbono del grupo acilo y los residuos de alcohol, sus propiedades se vuelven diferentes. Tales éteres son sólidos. Su punto de fusión depende de la longitud de los radicales de carbono y la estructura de la molécula.
Estructura de los éteres y ésteres
Ambos compuestos tienen un enlace éter (-O-), pero en ésteres forman parte de un grupo funcional más complejo (-COO), en el que el primer átomo de oxígeno está unido al átomo de carbono por un enlace sencillo (-O-), y Segundo doble (= O).
Esquemáticamente se puede representar de la siguiente manera:
- Éter: R - O - R1
- Ester: R - COO - R1
Dependiendo de los radicales en R y R1, los éteres se dividen en:
- Ésteres simétricos: aquellos en los que los radicales alquilo son idénticos, por ejemplo, éter dipropílico, éter dietílico, éter dibutílico y similares.
- Ésteres asimétricos o mixtos con diferentes radicales, por ejemplo, etilpropil éter, metilfenil éter, butilisopropilo, etc.
Los ésteres se dividen en:
- Esteres de alcohol y ácido mineral: sulfato (-SO3H), nitrato (-NO2), etc.
- Ésteres de alcohol y ácido carboxílico, por ejemplo, C2H5CO-, C5H9CO-, CH3CO-, etc.
Considerar las propiedades químicas de los ésteres. Los éteres tienen una baja reactividad, por lo que a menudo se utilizan como disolventes. Reaccionan solo en condiciones extremas o con compuestos altamente reactivos. A diferencia de los ésteres, los ésteres son más reactivos. Entran fácilmente en reacciones de hidrólisis, saponificación, etc.
Éteres
Reacción de los éteres con haluros de hidrógeno:
La mayoría de los éteres se pueden descomponer cuando se exponen al ácido bromhídrico (HBr) para formar bromuros de alquilo o cuando interactúan con el ácido hidroxiódico (HI) para producir yoduros de alquilo.
CH3 - O - CH3 + HI = CH3 - OH + CH3I
CH3 - OH + HI = CH3I + H2O
Formación de compuestos de oxonio:
Ácidos sulfúricos, yodados y otros ácidos fuertes cuando interactúan con éteres forman compuestos de oxonio - productos del compuestoorden superior
CH3 - O - CH3 + HCl = (CH3) 2O ∙ HCl
Interacción de los éteres con sodio metálico:
Cuando se calientan con metales básicos, como el sodio metálico, los éteres se dividen en alcoholatos y alquil sodio.
СН3 - О - СН3 + 2Na = СН3 - ОNa + СН3 - Na
Auto-oxidación de los éteres:
En presencia de oxígeno, los éteres se autooxidan lentamente para formar peróxido de idalquilo hidroperóxido. La autooxidación es la oxidación espontánea de un compuesto en el aire.
C2H5 - O - C2H5 + O2 = CH3 - CH (UN) - O - C2H5
Ésteres
Hidrólisis de ésteres:
En un ambiente ácido, el éster se hidroliza para formar el ácido y el alcohol correspondientes.
CH3 - COO - C2H5 = CH3 - COOH + H2O
Saponificación de ésteres:
A temperaturas elevadas, los ésteres reaccionan con soluciones acuosas de bases fuertes, como el hidróxido de sodio o potasio, para formar sales de ácidos carboxílicos. Las sales de los ácidos carbónicos se llaman jabones. El subproducto de la reacción de saponificación es el alcohol.
CH3 - COO - C2H5 + NaOH = CH3 - COONa + C2H5 - OH
Reacciones de reesterificación (intercambio):
Los ésteres entran en reacciones de intercambio bajo la acción del alcohol (alcoholisis), ácidos (acidólisis) o intercambio doble, con la interacción de dos ésteres.
СН3 - СОО - С2Н5 + С3Н7 - ОН = СН3 - СОО - С3Н7 + С2Н5 - ОH
CH3 - COO - C2H5 + C3H7 - COOH = C3H7 - COO - C2H5 + CH3 - COOH
СН3 - СОО - С2Н5 + С3Н7 - СОО - СН3 = СН3 - СОО - СН3 + С3Н7 - СОО - С2Н5
Reacciones que reaccionan con el amoníaco:
ÉsteresPuede interactuar con el amoníaco (NH3) con la formación de amida y alcohol. Por el mismo principio, reaccionan con aminas.
СН3 - СОО - С2Н5 + No3 = СН3 - СО - NHН + С2Н5 - ОH
Reacciones de reducción de éster:
Los ésteres se pueden reducir con hidrógeno (H2) en presencia de cromita de cobre (Cu (CrO2) 2).
CH3 - COO - C2H5 + 2H2 = CH3 - CH2 - OH + C2H5 - OH