El concepto de una molécula (y las ideas acerca de la estructura molecular de una sustancia, la estructura de la molécula en sí) derivadas de ella hace posible comprender las propiedades de las sustancias que crean el mundo. Los estudios físico-químicos modernos, así como los primeros, se basan y se basan en el gran descubrimiento de la estructura atómico-molecular de la materia. La molécula es un solo "detalle" de todas las sustancias, cuya existencia fue sugerida por Demócrito. Por lo tanto, es precisamente su estructura e interrelación con otras moléculas (que forman una cierta estructura y composición) lo que determina /explica todas las diferencias entre las sustancias, su tipo y propiedades.
La molécula en sí misma, al no ser el constituyente más pequeño de una sustancia (que es un átomo), tiene una cierta estructura, propiedades. La estructura de la molécula está determinada por el número de átomos definidos en ella y la naturaleza del enlace (covalente) entre ellos. Esta composición no cambia, incluso si la sustancia se convierte a otro estado (como ejemplo, sucede con el agua, esto se discutirá más adelante).
La estructura molecular de una sustancia se fija mediante una fórmula que proporciona información sobre los átomos, su número. Además, las moléculas que constituyen la sustancia /cuerpo no son estáticas: ellas mismas son móviles: los átomos giran, interactuando entre sí (atraer /repeler).
Características del agua, su condición
La composición de una sustancia como el agua (así como su fórmula química) es familiar para todos. Cada una de sus moléculas consta de tres átomos: un átomo de oxígeno, indicado por la letra "O", y los átomos de hidrógeno, el latín "H", en el número2 La forma de la molécula de agua no es simétrica (similar a un triángulo isósceles).
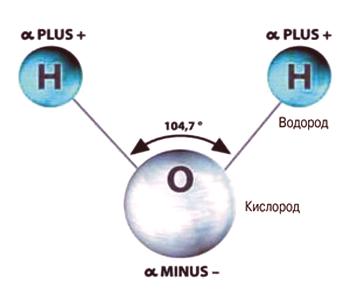
Molécula de agua
El agua, como sustancia, sus moléculas, reacciona al "ambiente" externo, indicadores ambientales: temperatura, presión. Dependiendo de esto último, el agua puede cambiar el estado, de los cuales hay tres:
- El estado natural más habitual del agua es el líquido. La estructura molecular (dihidrol) de un orden peculiar en el que las moléculas individuales rellenan (mediante enlaces de hidrógeno) los vacíos.
- El estado del vapor, en el que la estructura molecular (hidrol) está representada por moléculas individuales entre las cuales no se forman enlaces de hidrógeno.
- El estado sólido (el hielo mismo) tiene una estructura molecular (trihidrol) con enlaces de hidrógeno fuertes y estables.
Además de estas diferencias, naturalmente, las formas de "transicionar" una sustancia de un estado (líquido) a otro también difieren. Estas transiciones y transforman la sustancia, y provocan la transferencia de energía (liberación /absorción). Entre ellos se encuentran los procesos directos: la conversión de agua líquida en vapor (evaporación), en hielo (congelación) y reversa en líquido de vapor (condensación), de hielo (fusión). Además, el estado del agua (vapor y hielo) se puede transformar entre sí: sublimación - hielo a vapor, sublimación - el proceso inverso.
Especificidad del hielo como estado de agua
Es ampliamente conocido que el hielo se congela (transformado de agua) cuando cruza la temperatura en la dirección de disminuir el límite a cero grados. Aunque enTodo esto es un fenómeno claro, hay algunos matices. Por ejemplo, el estado del hielo es ambiguo, sus tipos y modificaciones son diferentes. Se diferencian principalmente en las condiciones en que surgen: temperatura, presión. Ya hay quince modificaciones de este tipo.
El hielo en sus diversas formas tiene una estructura molecular diferente (las moléculas son indistinguibles de las moléculas de agua). Hielo natural y natural, en la terminología científica denominada hielo Ih, una sustancia con una estructura cristalina. Es decir, cada molécula con sus cuatro "vecinos" que la rodean (la distancia entre todos es igual) crea una forma geométrica de un tetraedro. Otras fases del hielo tienen una estructura más compleja, por ejemplo, la estructura altamente ordenada del hielo trigonal, cúbico o monoclínico.
Las principales diferencias entre el hielo y el agua a nivel molecular
El primero y no directamente relacionado con la estructura molecular del agua y el hielo es la diferencia entre ellos, un indicador de la densidad de una sustancia. La estructura cristalina inherente al hielo, cuando se forma, contribuye a una disminución simultánea de la densidad (de un indicador de casi 1000 kg /m³ a 916.7 kg /m³). Esto estimula un aumento de volumen del 10%.
La principal diferencia en la estructura molecular de estos estados agregativos de agua (líquido y sólido) enes la cantidad, tipo y fuerza de los enlaces de hidrógeno entre las moléculas . En el hielo (estado sólido) combinan cinco moléculas, y los enlaces de hidrógeno son más fuertes.
Las moléculas de las sustancias del agua y el hielo, como se mencionó anteriormente, son las mismas. Pero un átomo en las moléculas de hielo.El oxígeno (para crear una "red" cristalina de la sustancia) forma enlaces de hidrógeno (dos) con las moléculas "vecinas".
Distingue la sustancia del agua en sus diferentes estados (agregativos) no solo la estructura de la disposición de las moléculas (estructura molecular), sino también su movimiento, la fuerza de la relación /atracción entre ellas. Las moléculas de agua en estado líquido se atraen de manera más bien débil, lo que garantiza la fluidez del agua. En el hielo sólido, la atracción de las moléculas es la más fuerte, por lo que su actividad física es pequeña (garantiza la constancia de la forma del hielo).